Rheumatoide Arthritis
- Autor(en): Urspeter Masche
- pharma-kritik-Jahrgang 39
, Nummer 1, PK1016
Redaktionsschluss: 28. April 2017
DOI: https://doi.org/10.37667/pk.2017.1016 - PDF-Download der Printversion dieser pharma-kritik Nummer
Die rheumatoide Arthritis, die bei rund 1% der Bevölkerung (bei Frauen deutlich mehr als bei Männern) und am häufigsten im Alter zwischen 40 und 70 Jahren auftritt, ist charakterisiert durch die Synovialitis. Die entzündete Synovialmembran wird hyperplastisch und führt, in Knorpel- und Knochengewebe eindringend, zu Erosionen. Die wichtigsten Symptome sind Gelenkschmerzen und -schwellungen sowie eine morgendliche, mehr als eine Stunde anhaltende Gelenksteifigkeit. Die Gelenke sind meist symmetrisch befallen, Hand- und Fussgelenke häufiger als grosse, proximale Gelenke. Die Diagnose erschliesst sich aus klinischen Befunden, Laborwerten (Entzündungsparameter, Rheumaserologie) und radiologischen Untersuchungen. Bei den Laboruntersuchungen sind die Antikörper gegen citrullinierte Proteine (ACPA) hervorzuheben, deren Sensitivität und Spezifität diejenige der Rheumafaktoren (RF) übertrifft – wobei sich die maximale Aussagekraft aus der Kombination von RF und ACPA ergibt (nicht geeignet sind RF und ACPA als Verlaufsparameter). Bei den radiologischen Abklärungen sind Röntgenaufnahmen die verbreitetste Untersuchung. Sensitivere Methoden, mit denen sich Gelenkentzündungen in einem früheren Stadium dokumentieren lassen, sind Sonographie und MRT. Insbesondere die Sonographie gewinnt für Diagnose und Verlaufskontrolle an Bedeutung.
Das Bild einer rheumatoiden Arthritis reicht von leichten, selbstlimitierenden Gelenkbeschwerden bis zur schweren Systemerkrankung, bei der auch andere Organe wie Lunge, Herz, Gefässe oder Haut betroffen sein können. Die Prognose lässt sich anhand verschiedener Faktoren abschätzen. Als ungünstig zu werten sind: stark erhöhter ACPA-Wert, frühes Auftreten von Erosionen, viele befallene Gelenke (vor allem im Frühstadium) und extraartikuläre Manifestationen.
Da mit jeder Verzögerung das Risiko irreparabler Schäden steigt, sollte die Diagnose einer rheumatoiden Arthritis so rasch wie möglich gestellt werden. Diesem Ziel dienen neue Kriterien, die gemeinsam von der amerikanischen und der europäischen Rheumatologiegesellschaft (ACR und EULAR) formuliert worden sind. Sie orientieren sich nur noch an der Zahl der betroffenen Gelenke, an der Symptomdauer, an den serologischen Befunden und am CRP-Wert bzw. der Blutsenkungsreaktion.(1)
Sobald die Diagnose feststeht, sollte eine Behandlung mit einem Basismedikament («Disease-modifying antirheumatic drug» [DMARD]) begonnen werden, womit der Krankheitsprozess beeinflusst und die Gelenkdestruktionen gebremst werden. Angestrebt wird ein Zustand möglichst niedriger Krankheitsaktivität, was im Idealfall eine Remission bedeutet. Die Basismedikamente (die unten im Detail vorgestellt werden) lassen sich unterteilen in die herkömmlichen, synthetisch hergestellten Substanzen sowie in die neuen, mehrheitlich biotechnologisch produzierten Mittel (Biologika).
Steroide und allenfalls auch nicht-steroidale Entzündungshemmer können als Ergänzung der Basistherapie zur Symptomlinderung beitragen. Vor allem am Anfang der Behandlung dienen Steroide mit ihrer raschen Entzündungshemmung zur Überbrückung; denn mit der Wirkung der Basismedikamente kann erst nach einigen Wochen gerechnet werden. Steroide besitzen wahrscheinlich ebenfalls einen gewissen basistherapeutischen Effekt und scheinen in Kombination mit eigentlichen Basismedikamenten die Verlangsamung der Gelenkdestruktionen zu unterstützen.(2) Allerdings fehlen systematische Untersuchungen, die auch die Nachteile einer Steroidbehandlung miteinbeziehen. Deshalb hat man sich in den führenden Behandlungsrichtlinien darauf festgelegt, dass Steroide möglichst kurz und niedrig dosiert einzusetzen seien.(3,4) Eine Steroidbehandlung sollte immer von einer Osteoporose-Prophylaxe begleitet sein, umso mehr als die rheumatoide Arthritis per se als Risikofaktor für eine Osteoporose zu beurteilen ist.
Die Wirkung einer Basistherapie lässt sich mit Hilfe von Messinstrumenten abschätzen, bei denen zum Beispiel die betroffenen Gelenke, Schmerzangaben und Entzündungswerte quantifiziert werden. Gut bekannt ist die von der ACR entwickelte Skala: das Erreichen einer 20%igen Besserung (ACR20) wird häufig als sensitiver primärer Endpunkt in klinischen Studien gewählt; analog dazu lassen sich höhere Schwellen festlegen (z.B. ACR50 oder ACR70), die aus klinischer Sicht relevanter sind. Im Gegensatz dazu liefert die «Disease Activity Scale» (DAS) kein dichotomes Ergebnis, sondern einen kontinuierlichen Wert, was einer relativen Einstufung der Krankheitsaktivität dienlicher ist. Üblicherweise wird der DAS28-Wert verwendet, bei dem 28 Gelenke in die Beurteilung einfliessen; er reicht von 2 bis 10 Punkte, wobei ein Wert unter 2,6 Punkten als Remission taxiert wird. Um Krankheitsaktivität und das Erreichen einer Remission noch genauer beurteilen zu können, sind von der ACR/EULAR Indizes vorgeschlagen, die auch subjektive Globaleinschätzungen enthalten.(5) Für härtere Endpunkte wie für das radiologisch zu erfassende Ausmass der Gelenkzerstörung existieren ebenfalls Messskalen («Larsen-Score» oder «Sharp-Score»).
Konventionelle Basismedikamente
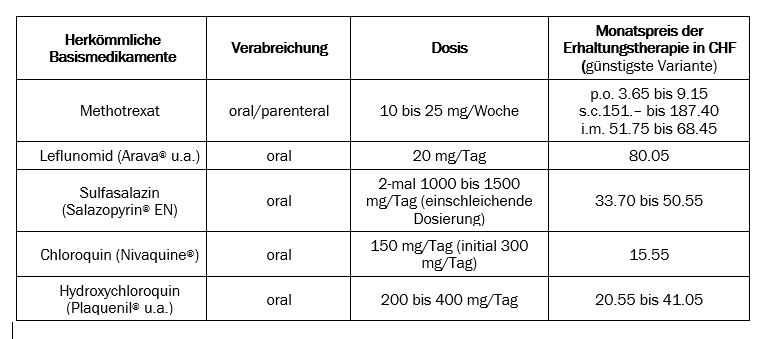
Die konventionellen Basismedikamente werden vertreten durch Methotrexat, Sulfasalazin (Salazopyrin® EN), Antimalariamittel und Leflunomid (Arava® u.a.). Andere Substanzen wie Goldsalze, Penicillamin oder Ciclosporin (Sandimmun® u.a.) haben keine praktische Bedeutung mehr.
Methotrexat
Methotrexat hemmt folsäureabhängige Enzyme und hat entzündungshemmende sowie antiproliferative Eigenschaften. Niedrigdosiertes Methotrexat zeichnet sich durch eine grosse – auch antierosive – Wirksamkeit und verhältnismässig geringe Toxizität aus. Als das bestuntersuchte Basismedikament ist es – unter Berücksichtigung von Nutzen, Risiken und Kosten – nach wie vor der Fixpunkt bei der Behandlung der rheumatoiden Arthritis. Methotrexat wird bei der rheumatoiden Arthritis einmal pro Woche in einer Dosis von 10 bis 25 mg verabreicht. Da wirksamer und meist verträglicher, wird die subkutane oder intramuskuläre Verabreichung empfohlen. Die orale Gabe (max. 20 mg/Tag) sollte nur stattfinden, wenn Injektionen abgelehnt werden. Die biologische Verfügbarkeit von oralem Methotrexat schwankt erheblich und sinkt mit steigender Dosis, da die Resorption über einen sättigbaren Transportmechanismus stattfindet (Folattransporter-1). Bei stark eingeschränkter Leber- oder Nierenfunktion ist Methotrexat kontraindiziert. Patientinnen und Patienten sind dringend darauf hinzuweisen, dass Methotrexat nur einmal pro Woche einzusetzen ist.
Typische Nebenwirkungen von Methotrexat sind Übelkeit, Erbrechen, Durchfall, Mukositis und Leberenzymerhöhungen (das Risiko einer Leberzirrhose scheint unter den Dosen, wie bei der rheumatoiden Arthritis verschrieben, sehr gering zu sein). Seltener kommen Zytopenien, Haarausfall, interstitielle Lungenerkrankungen und Hautreaktionen vor.
Wenn Methotrexat mit Folsäure (oder Folinsäure) kombiniert wird, lässt sich die Inzidenz von gastrointestinalen und hepatischen Nebenwirkungen reduzieren.(6) Praktikabel ist die Einnahme von 1x 5 mg Folsäure pro Woche. Weil sich Methotrexat und Folsäure bei der gastrointestinalen Resorption möglicherweise beeinflussen, wird zu einem Abstand von 24 Stunden zwischen Methotrexat- und Folsäureeinnahme geraten.
In Kombination mit gewissen anderen Medikamenten wie zum Beispiel nicht-steroidalen Entzündungshemmern oder Cotrimoxazol (Bactrim®u.a.) kann der Methotrexat-Spiegel ansteigen.
Leflunomid
Leflunomid wird nach oraler Einnahme in den Metaboliten M1 umgewandelt, die pharmakologisch aktive Form, welche die Proliferation von aktivierten T-Lymphozyten hemmt. Der Abbau findet in der Leber statt, zur einen Hälfte über zytochromabhängige Reaktionen, zur anderen über eine direkte Glukuronidierung. Beim Metabolismus entstehen geringe Mengen von Trifluormethylanilin, das als potentiell kanzerogen angesehen wird. Der Metabolit M1 weist einen ausgeprägten hepatobiliären Kreislauf auf, was zur langen Halbwertszeit von ungefähr 2 Wochen beiträgt. Einer Metaanalyse zufolge lässt sich Leflunomid als ungefähr gleich wirksam einstufen wie Methotrexat oder Sulfasalazin.(7)
Mögliche Nebenwirkungen von Leflunomid sind Übelkeit, Durchfall, Kopfschmerzen, Blutdruckanstieg, verstärkter Haarausfall, Zytopenien und Hautreaktionen (Exantheme, Stevens-Johnson- und Lyell-Syndrom). Sehr häufig ist ein Leberenzymanstieg, auch Fälle von Leberversagen sind vorgekommen. In Kombination mit anderen lebertoxischen Substanzen (z.B. Methotrexat!) ist Vorsicht geboten.
Sulfasalazin
Sulfasalazin scheint ähnlich wirksam zu sein wie Methotrexat; der antierosive Effekt ist aber weniger dokumentiert. Die wichtigsten Nebenwirkungen sind gastrointestinale Beschwerden, Kopfschmerzen, Hautausschläge, Leberenzymerhöhungen, Leuko- und Thrombopenie. Sulfasalazin wird als das Basismedikament betrachtet, das am ehesten während der Schwangerschaft gegeben werden könnte.
Antimalariamittel
Die Antimalariamittel Chloroquin (Nivaquine®) und Hydroxychloroquin (Plaquenil® u.a.) sind wahrscheinlich weniger wirksam als Methotrexat, vor allem weil kein antierosiver Effekt nachgewiesen ist. Sie haben eine lange Halbwertszeit (1 bis 2 Monate) und eine langsam einsetzende Wirkung (3 bis 6 Monate). Antimalariamittel sind oft von gastrointestinalen Beschwerden begleitet. Auch Hautausschläge und Hämolysen können vorkommen. Gefürchtet ist die Retinopathie, die allerdings sehr selten auftritt; sie ist dosisabhängig und kann reversibel sein, wenn sie – durch jährliche ophthalmologische Kontrollen – rechtzeitig erkannt wird. Hydroxychloroquin gilt als weniger netzhautschädigend als Chloroquin.
Moderne Basismedikamente
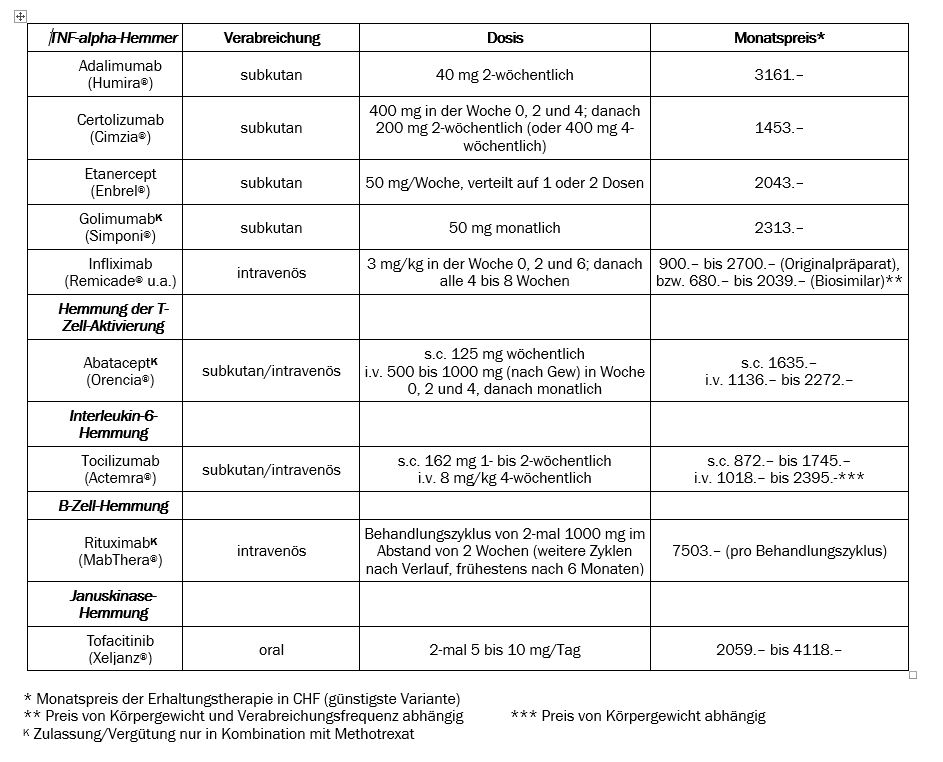
Bei den modernen Basismedikamenten unterscheidet man biologische von nicht-biologischen (d.h. synthetisch hergestellten) Substanzen. Zur ersten Gruppe gehören die TNF-alpha-Hemmer sowie die Nicht-TNF-alpha-Hemmer Abatacept (Orencia®), Tocilizumab (Actemra®) und Rituximab (MabThera®), zur zweiten Gruppe der Januskinase-Hemmer Tofacitinib (Xeljanz®).
Eine weitere biologische Substanz ist Anakinra, ein Interleukin-1-Rezeptor-Antagonist; das Medikament ist aber weniger wirksam als andere Biologika und in der Schweiz nicht erhältlich.
TNF-alpha-Hemmer
Der Tumornekrosefaktor alpha (TNF-alpha) ist ein Entzündungsmediator, der bei der rheumatoiden Arthritis eine entscheidende Rolle spielt. TNF-alpha bindet sich an membrangebundene Rezeptoren und setzt so die Entzündungsreaktion in Gang. Die Inaktivierung von TNF-alpha geschieht durch freie, lösliche TNF-alpha-Rezeptoren. Es gibt fünf TNF-alpha-Hemmer. Etanercept (Enbrel®) ist ein Fusionsprotein, bei dem zwei rekombinante TNF-alpha-Rezeptor-Moleküle mit dem Fc-Anteil von humanem Immunglobulin gekoppelt sind. Infliximab (Remicade®) ist ein chimärer, das heisst aus Mensch- und Mausanteil zusammengesetzter monoklonaler Antikörper gegen TNF-alpha; Infliximab wird mittlerweile auch in Form von billigeren «Biosimilars» angeboten. Golimumab (Simponi®) hat dieselben Aminosäurensequenzen wie Infliximab, ist aber rein humanen Ursprungs; Adalimumab (Humira®) ist ebenfalls ein ausschliesslich humaner Antikörper gegen TNF-alpha; Certolizumab (Cimzia®) besteht aus dem Fab-Fragment eines humanisierten Antikörpers (d.h. mit Mausanteil als Antigenbindungsstelle), das mit Polyethylenglykol (PEG) verbunden ist. Infliximab muss intravenös, die anderen vier TNF-alpha-Hemmer können subkutan verabreicht werden.
Eine Metaanalyse zeigte, dass mit TNF-alpha-Hemmern nach 6 Monaten signifikant mehr Behandelte einen ACR50-Wert erreichen als mit Placebo (RR 4,07; 95% CI 2,70–6,13). In einer Monotherapie waren TNF-alpha-Hemmer etwas wirksamer als Methotrexat, der Unterschied aber statistisch nicht signifikant. Der Effekt war nicht bei allen TNF-alpha-Hemmern gleich gross; daraus kann jedoch nicht auf unterschiedliche Wirksamkeit geschlossen werden, da keine Direktvergleiche bestehen.(8) Einer anderen Metaanalyse zufolge haben TNF-alpha-Hemmer in Kombination mit Methotrexat eine signifikant bessere antierosive Wirkung als Methotrexat allein.(9) Aus diesen Daten lässt sich ableiten, dass eine überlegene Wirkung von TNF-alpha-Hemmern vor allem in Kombination mit Methotrexat zum Tragen kommt.
TNF-alpha-Hemmer dämpfen die Immunabwehr, weshalb sie das Risiko von Infekten erhöhen; dazu gehört auch die Reaktivierung einer latenten Tuberkulose oder Hepatitis B. Als weitere Nebenwirkung ist die Zunahme einer Herzinsuffizienz nennen; sehr selten werden Zytopenien und demyelinisierende Erkrankungen festgestellt. Bei den subkutan verabreichten TNF-alpha-Hemmern können Hautreaktionen an der Injektionsstelle, bei Infliximab Überempfindlichkeitsreaktionen im Zusammenhang mit der Infusion vorkommen. Eine neue Metaanalyse weist darauf hin, dass TNF-alpha-Hemmer das Risiko einer Hypertonie erhöhen.(10) Andererseits wird diskutiert, dass die entzündungshemmende Wirkung der TNF-alpha-Hemmer das kardiovaskuläre Risiko eventuell günstig beeinflusst.(11) Dass TNF-alpha-Hemmer das Auftreten von malignen Tumoren allgemein begünstigen würden, hat sich bislang nicht beweisen lassen und wird von Fachleuten aufgrund der unterdessen jahrelangen Erfahrung praktisch ausgeschlossen. Eine Ausnahme bilden Melanome, die unter TNF-alpha-Hemmern möglicherweise etwas häufiger vorkommen.(12)
Abatacept
Abatacept – ein rekombinantes Fusionsprotein, bestehend aus dem «Cytotoxic T-Lymphocyte Antigen 4» (CTLA-4) und einem modifizierten Fc-Anteil eines menschlichen Immunoglobulins – hemmt die antigenunabhängige T-Zell-Kostimulation. Zusammen mit Methotrexat verabreicht, verspricht es im Vergleich zur Methotrexat-Monotherapie eine signifikant bessere Ansprechrate. Auch das Fortschreiten von Gelenkdestruktionen lässt sich gemäss einer Studie mit Abatacept hinausschieben.(13) Darüber hinaus wurde Abatacept in einer Doppelblindstudie mit Adalimumab verglichen (beide in Kombination mit Methotrexat), wobei sich auch in Bezug auf die radiologischen Veränderungen keine Unterschiede ergaben.(14)
Als Nebenwirkungen sind Kopfschmerzen, Schwindel, Dyspepsie, Hypertonie, erhöhtes Infektionsrisiko und seltener Überempfindlichkeitsreaktionen zu beachten.(15)
Tocilizumab
Bei Tocilizumab handelt es sich um einen humanisierten monoklonalen Antikörper, der sich an den Interleukin-6-Rezeptor bindet und die durch Interleukin-6 vermittelte Signalübertragung blockiert. Eine Behandlung mit Tocilizumab/Methotrexat erhöht im Vergleich zu alleinigem MethotreSxat die Wahrscheinlichkeit einer 50%igen Besserung (ACR50) um 3,8 (2,4–6,0) bzw. einer klinischen Remission (DAS28) um 10,6 (6,9–16,4).(16) Ebenso wurden Gelenkdestruktionen durch Tocilizumab signifikant stärker verzögert. Tocilizumab hat sich in Monotherapie gegenüber Adalimumab als überlegen erwiesen und ist das bislang einzige Biologikum, das in Monotherapie ähnlich gut wirksam zu sein scheint wie in Kombination mit Methotrexat.(17,18)
Mögliche Nebenwirkungen von Tocilizumab sind gastrointestinale Probleme (auch Perforationen), Neutropenie, Kopfschmerzen, Fieber, Hautausschläge, Juckreiz, Blutdruckerhöhung, Transaminasenanstieg, Dyslipidämie, Infektionen, Antikörperbildung und Überempfindlichkeitsreaktionen.(15)
Rituximab
Rituximab ist ein chimärer monoklonaler Antikörper gegen das auf B-Zellen sitzende CD20-Antigen und kann, wenn die Behandlung mit herkömmlichen Basismedikamenten und TNF-alpha-Hemmern versagt, in Kombination mit Methotrexat verwendet werden. In einer solchen Population lässt sich mit Rituximab die Wahrscheinlichkeit einer 50%igen Besserung signifikant erhöhen (OR 3,1 [2,5–4,0]).(19)
Wichtigste Nebenwirkungen sind Überempfindlichkeitsreationen während der Infusion und sehr selten eine progressive multifokale Leukenzephalopathie als Folge einer Reaktivierung des JC-Virus.(15)
Tofacitinib
Das synthetisch hergestellte Tofacitinib wirkt als Hemmer der Januskinasen (Tyrosinkinasen, die bei Entzündungsprozessen an der Signalübertragung beteiligt sind). Tofacitinib lässt sich in Monotherapie oder in Kombination zum Beispiel mit Methotrexat einsetzen. Bei Personen, die auf Methotrexat nicht genügend angesprochen haben, führt es zu einem bessern Ansprechen (ACR20) als Placebo.(20) Auch radiologische Veränderungen vermag Tofacinitib besser zu bremsen als Methotrexat, wie ein Vergleich bei bisher unbehandelten Personen zeigte.(21)
Als unerwünschte Wirkungen sind Diarrhoe, Kopfschmerzen, Blutdruckanstieg, Zytopenien, Hyperlipidämie und Infekte herauszustreichen.(15) Weil die Langzeitsicherheit von Tofacitinib schlechter dokumentiert als bei anderen modernen Basismedikamenten, wird es nicht unisono als Mittel der ersten Wahl genannt.
Behandlungsrichtlinien
Zur Wahl eines «richtigen» Basismedikamentes gibt es wenig fundierte Daten in Form von aussagekräftigen Vergleichen. Dennoch können die Behandlungsrichtlinien, die von Expertengremien erarbeitet worden sind, in ihren Grundsätzen als relativ unumstritten übernommen werden.
Wie erwähnt, sollte nach der Diagnose ohne Aufschub eine Basistherapie begonnen werden. Mit Verlaufskontrollen alle 3 (bis 6) Monate soll sichergestellt werden, dass allenfalls nötige Therapieanpassungen keine Verzögerung erfahren. Zur Standardisierung der Behandlung dient in der Schweiz das SCQM-Projekt («Swiss Clinical Quality Management in Rheumatoid Arthritis»), in das alle Patientinnen und Patienten durch die mitbetreuenden rheumatologischen Fachleute einbezogen werden sollten.
In der Regel startet man mit einem herkömmlichen Basismedikament in einer Monotherapie (plus ev. Steroid). Medikament der ersten Wahl ist Methotrexat; Sulfasalazin oder Leflonumid gelten als Alternativen, wenn Methotrexat nicht in Frage kommt. Lässt sich die Krankheitsaktivität mit einer ausreichend dosierten Monotherapie nicht genügend senken, soll eine Kombinationstherapie eingeleitet werden – wozu man Methotrexat entweder zusammen mit anderen herkömmlichen Basismedikamenten verabreicht (z.B. Zweierkombination mit Sulfasalazin oder Dreierkombination mit Sulfasalazin/Hydroxychloroquin) oder mit einem modernen Basismedikament verbindet. Bei ungenügendem Ansprechen auf eine Kombinationstherapie mit einem modernen Basismedikament sollte ein Austausch gegen ein anderes modernes Basismedikament erfolgen (wobei z.B. im Falle der TNF-alpha-Hemmer auch ein Wechsel innerhalb der Gruppe zulässig ist (22)). Miteinander sollen moderne Basismedikamente nicht kombiniert werden.
Die modernen Basismedikamente sind durch indirekte Vergleiche im Grossen und Ganzen als ähnlich wirksam einzuschätzen, so dass sich keine fixe Hierarchie formulieren lässt. Abgesehen von individuellen Voraussetzungen, welche die Wahl einer spezifischen Substanz bestimmen, kann man aber tendenziell die TNF-alpha-Hemmer als erste, die biologischen Nicht-TNF-alpha-Hemmer als zweite und Tofacitinib als dritte Wahl bezeichnen. Diese Einstufung widerspiegelt vor allem das Ausmass der klinischen Erfahrungen, die man mit den entsprechenden Substanzen gewonnen hat.
Engmaschige Kontrollen mit einem allmählichen Ausbau der Basistherapie («Step-Up»-Strategie) ist in den meisten Fällen das angemessene Vorgehen. Ein «aggressiverer» Therapieplan – indem man sehr rasch zu modernen Basismedikamenten greift, eventuell sogar schon zu Beginn der Behandlung – hat sich bislang nicht als eindeutig überlegen gezeigt und ist höchstens bei sehr ungünstigen Prognosefaktoren gerechtfertigt.(23)
Bei einer Basistherapie handelt es sich grundsätzlich um eine Langzeit- oder Dauertherapie. Bei einer anhaltenden Remission kann eine vorsichtige Dosisreduktion ins Auge gefasst werden.(3,24)
Vor einer Behandlung mit Biologika wird ein Screening auf Tuberkulose, Hepatitis B und C sowie HIV empfohlen.(25) Leute mit einer rheumatoiden Arthritis sollten die üblichen empfohlenen Impfungen erhalten, wobei bei einer Basistherapie wegen der Immunsuppression auf Lebendimpfstoffe verzichtet werden sollte (Ausnahmen sind Sulfasalazin und Antimalariamittel). Bei Biologika kann die Wirkung der Impfstoffe vermindert ausfallen; besonders gilt dies für die Grippe- und Pneumokokkenimpfung bei Personen unter Rituximab und Abatacept.
Vor Operationen wie zum Beispiel einer Arthroplastik wird bei den modernen Basismedikamenten in der Regel ein vorübergehendes Absetzen empfohlen, um kein erhöhtes Wundinfektrisiko einzugehen.(26)
Zu den besprochenen Basismedikamenten ist im Internet eine tabellarische Übersicht (Tabelle 1i) publiziert; für weitergehende Informationen (auch zu Vorabklärungen und Kontrolluntersuchungen) hilft die Website der Schweizerischen Gesellschaft für Rheumatologie (www.rheuma-net.ch). Ferner ist auf Spezialsprechstunden hinzuweisen, die für besondere Probleme angeboten werden (z.B. für rheumakranke Schwangere im Inselspital Bern).
Schlussfolgerungen
Die rheumatoide Arthritis ist eine chronische Krankheit, die zu grosser Behinderung führen und die Lebenserwartung vermindern kann. Rasch mit einer Basistherapie zu beginnen, gilt aus prognostischen Gründen als essentiell. Wie in anderen medizinischen Bereichen versucht man bei der rheumatoiden Arthritis heute, die Behandlung zu individualisieren, indem sich die Intensität der Behandlung am Ziel der Remission orientiert («Treat-to-target»).
Methotrexat bleibt das Basismedikament der ersten Wahl. Werden mit Methotrexat (oder einer anderen Monotherapie) die Remissionskriterien nicht erreicht, sollte man auf eine Kombinationstherapie wechseln. Hierfür werden in vielen Fällen biologische oder andere moderne Basismedikamente verwendet. Eine überlegene Wirkung von modernen Basismedikamenten wird meistens nur via Kombinationstherapie erzielt. Durch die verschiedenen Basismedikamente haben sich die Behandlungsmöglichkeiten und die Prognose für viele Patientinnen und Patienten verbessert; das äussert sich auch darin, dass invalidisierende Krankheitsverläufe mit schweren Gelenkdeformationen laut Fachleuten selten geworden seien. Es darf aber nicht ausser Acht gelassen werden, dass die modernen Basismedikamente teuer und mit nicht zu unterschätzenden Risiken behaftetsind.
Literatur
- 1) Aletaha D et al. Ann Rheum Dis 2010; 69: 1580-8
- 2) Kavanaugh A, Wells AF. Rheumatology (Oxford) 2014; 53: 1742-51
- 3) Smolen JS et al. Ann Rheum Dis 2014; 73: 492-509
- 4) Singh JA et al. Arthritis Care Res (Hoboken) 2016; 68: 1-25
- 5) Bykerk VP, Massarotti EM. Rheumatology (Oxford) 2012; 51 Suppl 6: vi16-20
- 6) Shea B et al. J Rheumatol 2014; 41: 1049-60
- 7) Golicki D et al. Pol Arch Med Wewn 2012; 122: 22-32
- 8) Aaltonen KJ et al. PLoS One 2012; 7: e30275
- 9) Graudal N, Jürgens G. Arthritis Rheum 2010; 62: 2852-63
- 10) Zhao Q et al. Medicine (Baltimore) 2015; 94: e731
- 11) Toussirot É. Expert Opin Drug Saf 2015; 14: 525-32
- 12) Ramiro S et al. Ann Rheum Dis 2014; 73: 529-35
- 13) Maxwell L, Singh JA. Cochrane Database Syst Rev 2009; (4): CD007277
- 14) Schiff M et al. Ann Rheum Dis 2014; 73: 86-94
- 15) Anon. Med Lett Drugs Ther 2014; 56: 127-32
- 16) Singh JA et al. Cochrane Database Syst Rev 2010; (7): CD008331
- 17) Navarro G et al. Semin Arthritis Rheum 2014; 43: 458-69
- 18) Favalli EG et al. Biomed Res Int 2014; 2014: 831603
- 19) Hernández-Cruz B et al. Reumatol Clin 2011; 7: 314-22
- 20) Song GG et al. Korean J Intern Med 2014; 29: 656-63
- 21) Lee EB et al. N Engl J Med 2014; 370: 2377-86
- 22) Dokument «Canadian Agency for Drugs and Technologies in Health»: http://bit.do/cTnXr
- 23) Gramling A, O’Dell JR. Rheum Dis Clin North Am 2012; 38: 311-25
- 24) Lau CS et al. Int J Rheum Dis 2015; 18: 685-713
- 25) Aletaha D, Kerschbaumer A. Z Rheumatol 2017; 76: 8-14
- 26) Goodman SM. Semin Arthritis Rheum 2015; 44: 627-32
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK1016
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.